生物学的同等性・溶出試験 | フィナステリド錠
生物学的同等性・溶出試験
生物学的同等性試験
フィナステリド錠0.2mg「VTRS」
フィナステリド錠0.2mg「VTRS」は「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン(平成24年2月29日薬食審査発0229第10号)」に基づき、フィナステリド錠1mg「VTRS」を標準品としたとき、溶出挙動が等しく、生物学的に同等とみなされた。
社内資料:溶出試験(フィナステリド錠0.2mg「VTRS」)
フィナステリド錠1mg「VTRS」
「後発医薬品の生物学的同等性試験ガイドライン」に従って、フィナステリド錠1mg「VTRS」と標準品を健康成人男子にそれぞれ1錠(フィナステリドとして1mg)を、絶食下で単回投与(クロスオーバー法)した。 両剤の薬物動態パラメータ(AUC、Cmax)について統計解析を行った結果、両剤の生物学的同等性が確認された。

試験製剤および標準品投与後の血漿中フィナステリド濃度推移は以下の図のようであった。
試験製剤および標準品の薬物動態パラメータの対数値の平均値の差の90%信頼区間はlog(0.80)~log(1.25)の範囲であり、両剤の生物学的同等性が確認された。
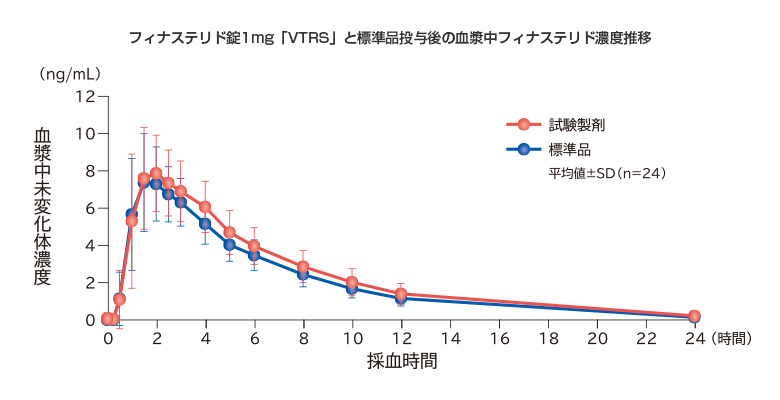

社内資料:生物学的同等性試験(フィナステリド錠1mg「VTRS」)
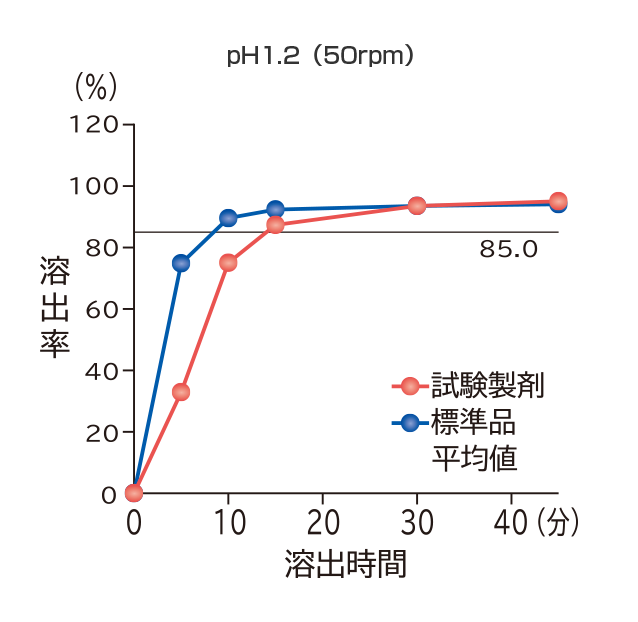
溶出試験
フィナステリド錠0.2mg「VTRS」
「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン」(平成24年2月29日薬食審査発第0229第10号)に基づき、フィナステリド錠1mg「VTRS」を標準品としてフィナステリド錠0.2mg「VTRS」の溶出試験を実施した結果、いずれの試験液においても溶出挙動の同等性が示され、両製剤は生物学的に同等とみなされた。

すべての試験液において、標準品は15分以内に平均85%以上溶出し、15分の時点においてフィナステリド錠0.2mg「VTRS」の平均溶出率は、平均85%以上であった。
また、最終比較時点におけるフィナステリド錠0.2mg「VTRS」の個々の溶出率は、平均溶出率±15%の範囲を超えるものは12個中1個以下で、±25%の範囲を超えるものはなかった。
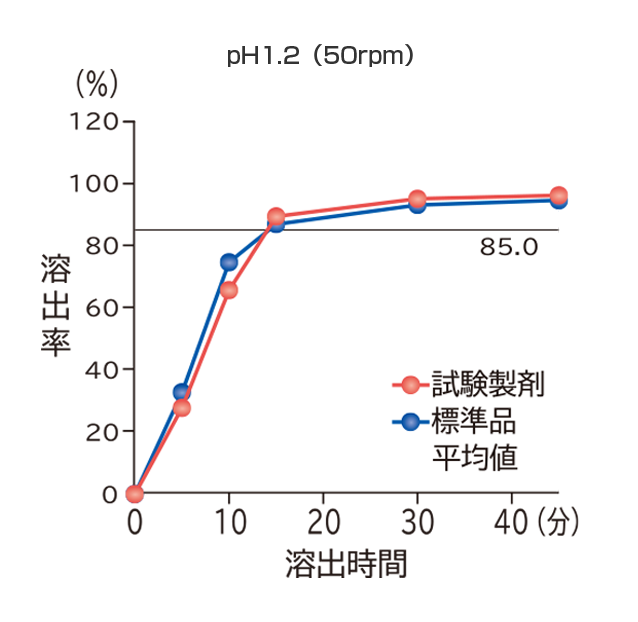
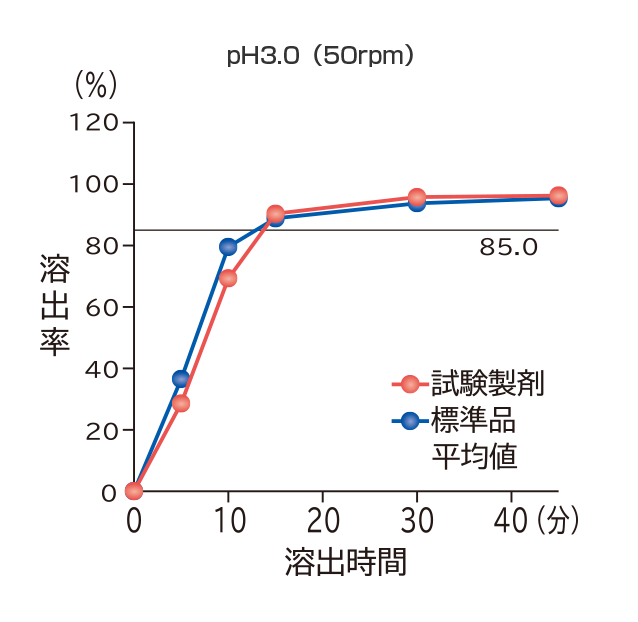
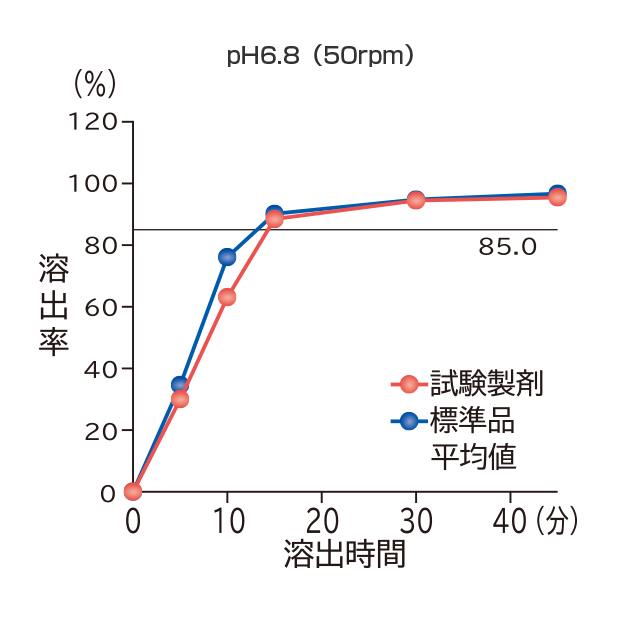
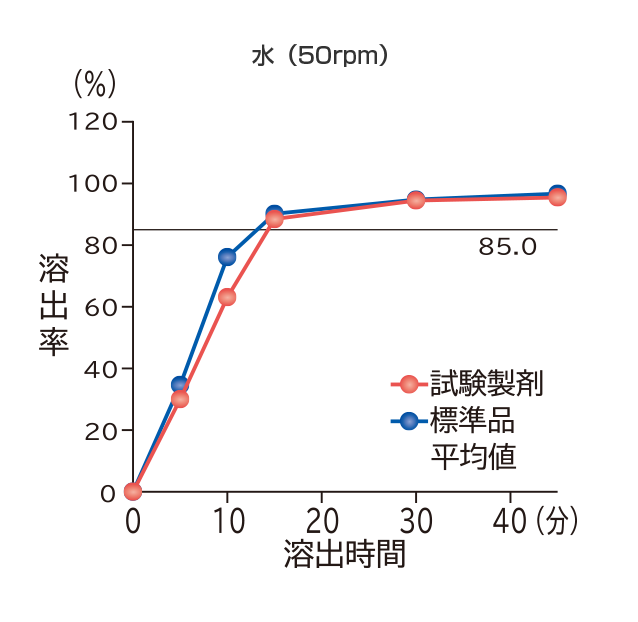
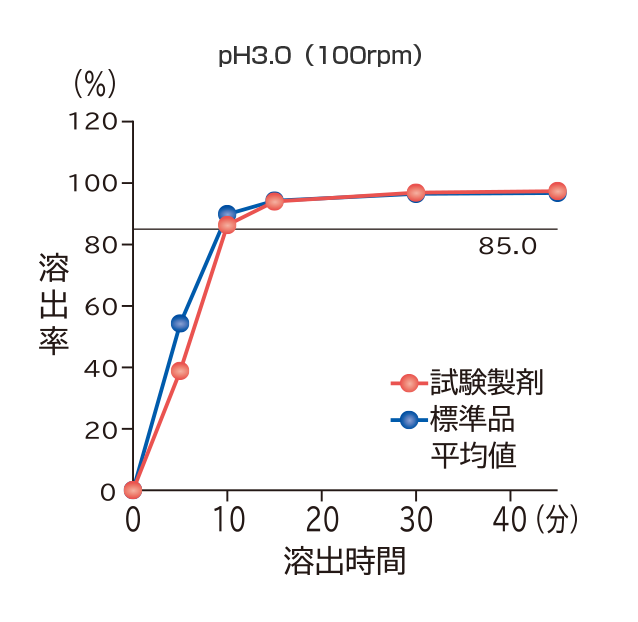
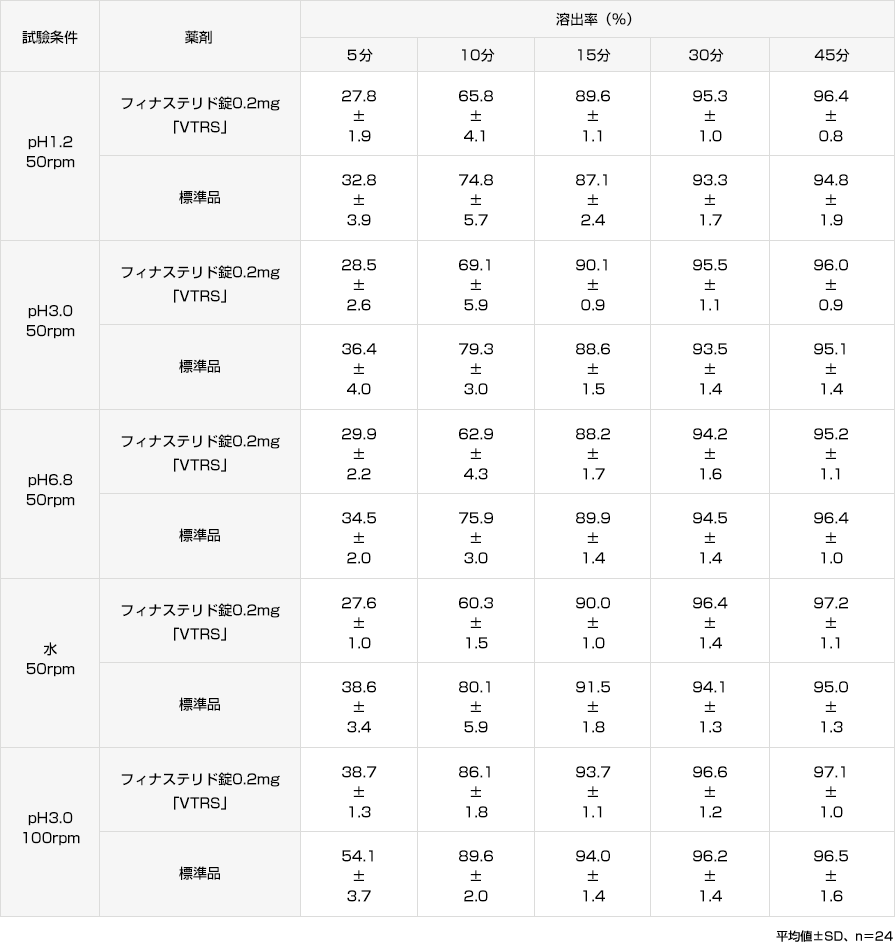
社内資料:溶出試験(フィナステリド錠0.2mg「VTRS」)
フィナステリド錠1mg「VTRS」
フィナステリド錠1mg「VTRS」と標準品の溶出試験を実施した結果、フィナステリド錠1mg「VTRS」はいずれの試験液においても溶出挙動が類似し、「後発医薬品の生物学的同等性試験ガイドライン」の溶出挙動の同等性の判定基準に適合した。

すべての試験液において、標準品は15分以内に平均85%以上溶出し、15分の時点においてフィナステリド錠1mg「VTRS」の平均溶出率は、平均85%以上であった。
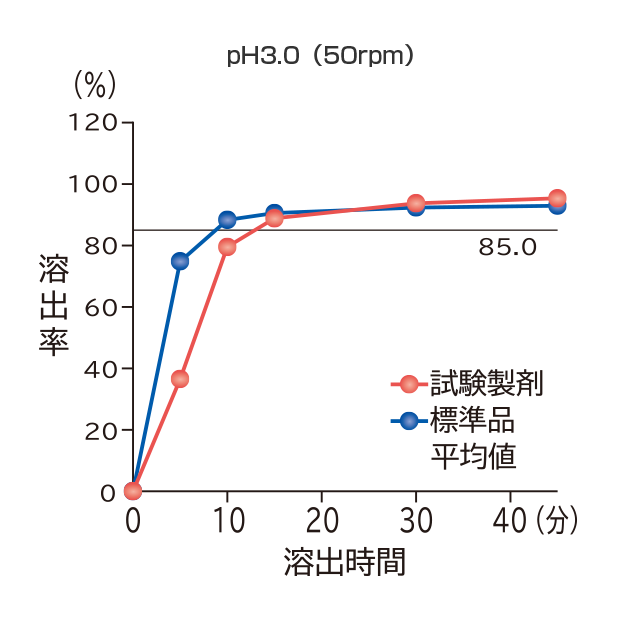
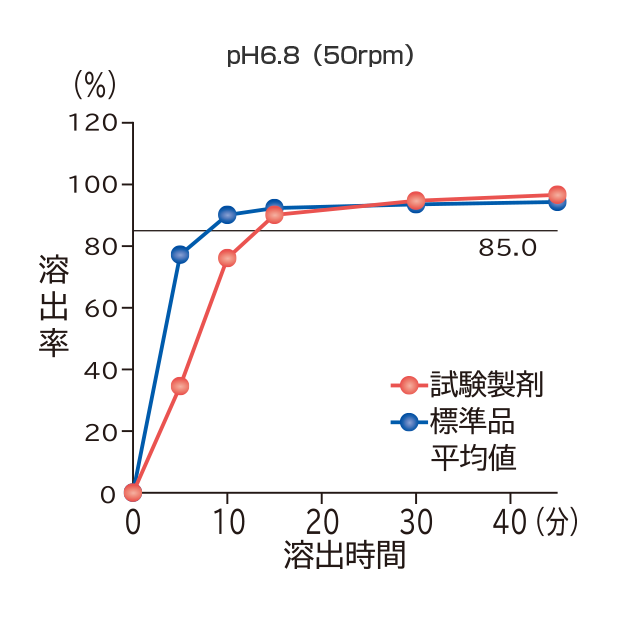
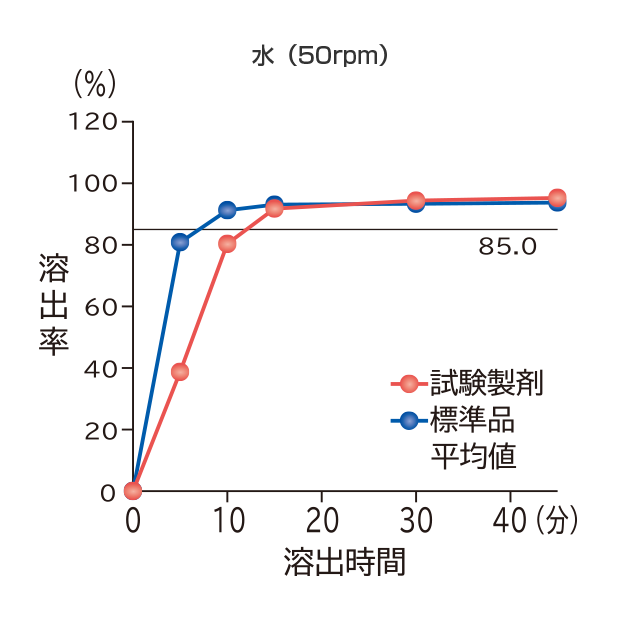
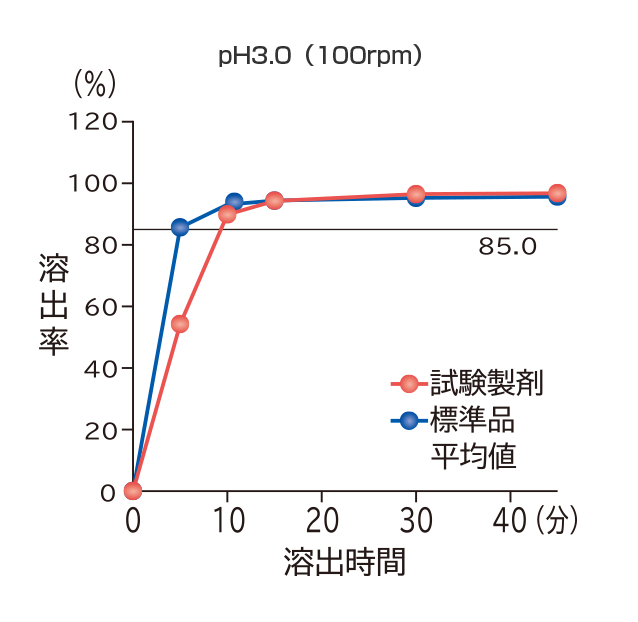
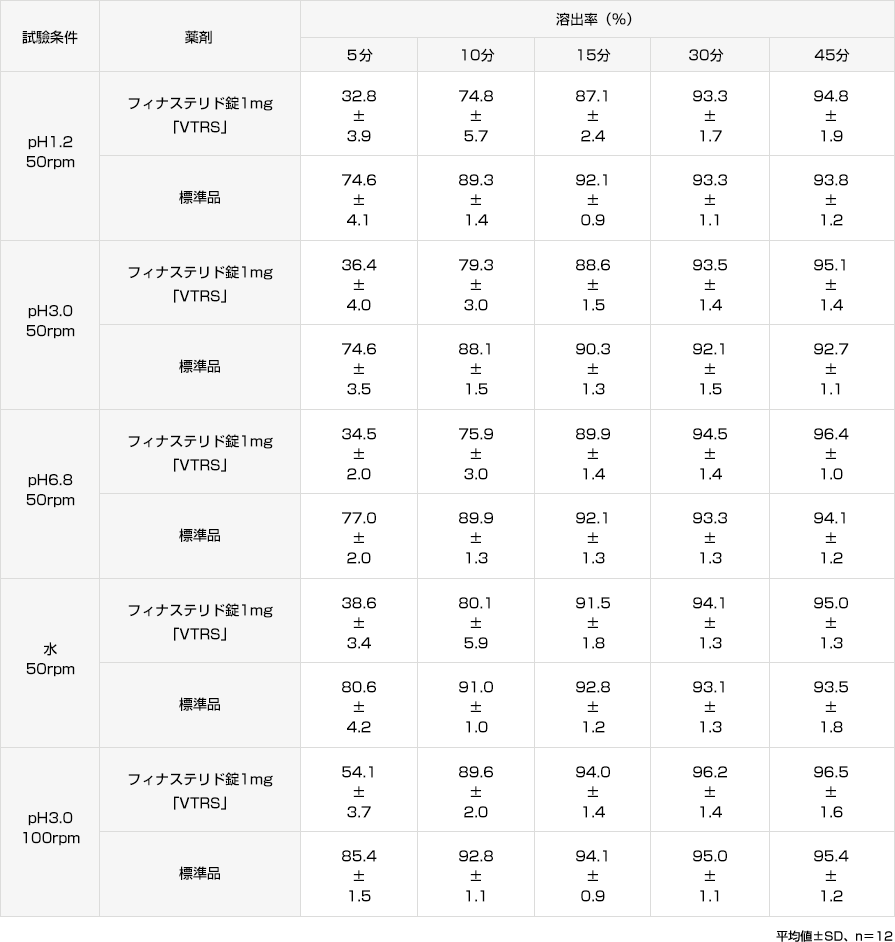
社内資料:溶出試験(フィナステリド錠1mg「VTRS」)
「警告・禁忌を含む使用上の注意」等については DI情報をご参照ください。
DI情報をご参照ください。
