カデュエット配合錠の服薬アドヒアランスへの影響(参考情報)
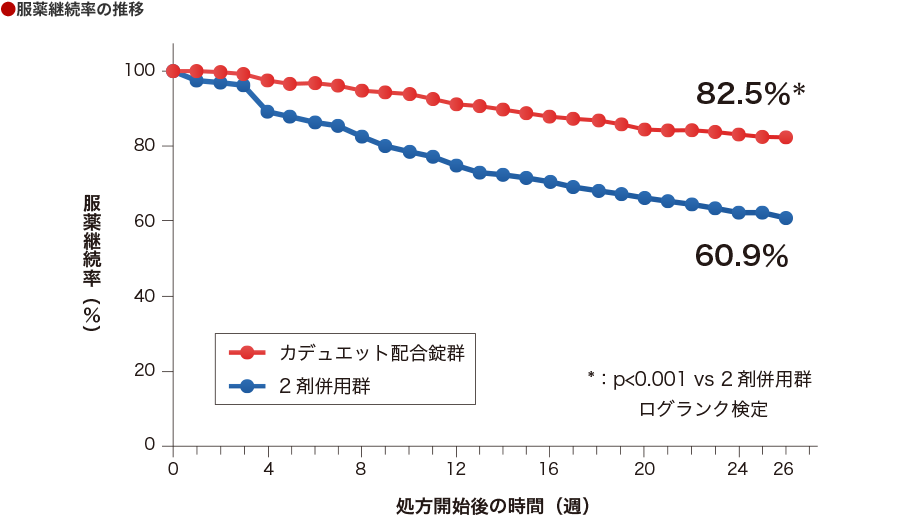
アムロジピン服用中でスタチンの追加治療が必要な患者さんにおいて、服用開始からの服薬継続率をカプランマイヤー曲線で比較した結果、カデュエット配合錠群は2剤併用群よりも高い服薬継続率を示しました。

・平均PDC
カデュエット配合錠群:96.1%、2剤併用群:89.1%(p<0.001、Wilcoxon rank sum test)
・PDC 80%以上の患者(アドヒアランス良好患者)の割合
カデュエット配合錠群:97.3%、2剤併用群:84.7%(p<0.001、Fisher's exact test)
※ proportion of days covered:解析対象日数のうち実際に薬が処方され患者が薬を手元に有していた日数の割合。
片田 淳ほか: Progress in Medicine 34(1): 115, 2014(著者の一部はヴィアトリス社の製造販売承認承継元であるファイザー社に所属)
目的
アムロジピンを服用していて、高コレステロール血症治療のためにスタチンが新規追加処方された患者において、スタチンに対するアドヒアランスが配合剤を用いた場合と2剤併用の場合で異なるかどうかを検討する。
対象
調剤レセプトデータベースより、高血圧症・高コレステロール血症合併患者のうち、アムロジピンによる降圧治療を受けていて、後からアトルバスタチンによる高コレステロール血症治療が開始になった患者1,264例(解析対象患者の中で、アトルバスタチンが追加になった際に、アムロジピンからアムロジピン・アトルバスタチン配合錠へと変薬になった患者632例を「カデュエット配合錠群」とした。カデュエット配合錠群の患者に対して、性別と年齢が一致する患者を、アムロジピンとアトルバスタチンの2剤の処方となった患者の中からランダムに選び出し(マッチング)、マッチングにより得られた患者集団を「2剤併用群」とした。マッチングは、患者比率1:1で行い、2剤併用群の患者数も632例とした。)。
方法
24週フォローし、アトルバスタチンに対する服薬継続率をPDCを用いて検証した。カデュエット配合錠群、2剤併用群それぞれについて、カプランマイヤー曲線で服薬継続率を示し、26週の全体の服薬継続率をログランク検定で比較した。
評価項目
アドヒアランス(PDCおよび服薬継続率)、アドヒアランス状況に影響を与える因子。
解析計画
PDCの平均値の比較にはWilcoxon rank sum test、割合の比較にはFisher's exact testを用いた。
服薬継続率の2本のカプランマイヤー曲線の比較は、ログランク検定を用いて行った。
PDCが80%以上を示した患者を「アドヒアランス良好」、80%未満を示した患者を「アドヒアランス不良」とする2区分値を用いた評価を行った。アドヒアランス良好・不良の2区分変数をアウトカム、性別、年齢、治療薬(配合錠/2剤併用)、1日当たりの服用剤数、通院している病院の規模、併用薬別の使用の有無を説明変数とした多重ロジスティック回帰分析を行った。
安全性
論文中に記載なし。
Limitations
(1)調剤レセプトデータに基づいた調査であり、定期的に来院して薬は受け取るが、受け取った薬を必ずしも飲まないというケースがあるため、PDCはアドヒアランスを過大評価している可能性がある。(2)臨床データを得ることができていないため、解析対象となった患者の血圧、LDLコレステロール値について情報がない。(3)患者の疾患名、疾患の重症度、過去のイベント既往歴などのデータがないため、これらの因子が2群間でどのように異なり、それが結果にどの程度影響を与えるのかという観点の評価ができていない。
