カデュエット配合錠の臨床成績
カデュエット配合錠のLDLコレステロール低下作用と降圧作用(国内第Ⅲ相臨床試験)
カデュエット配合錠4番は、ベースラインよりLDLコレステロールを40.6%、収縮期血圧を18.9mmHg低下させました。
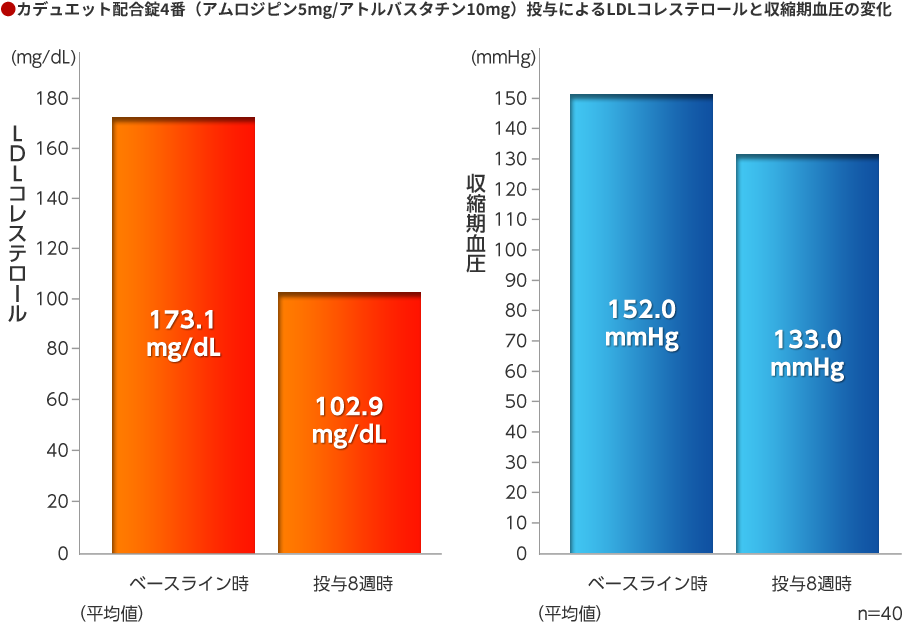
カデュエット配合錠4番(アムロジピン5mg/アトルバスタチン10mg)投与による、投与8週時におけるベースラインからのLDLコレステロールの変化率(%)と収縮期血圧の変化量(mmHg)[最小二乗平均(両側95%信頼区間)](主要評価項目)
LDLコレステロール変化率:-40.6(-43.6, -37.6)、収縮期血圧変化量:-18.9(-22.3, -15.5)
● 以下、カデュエット配合錠1番(アムロジピン2.5mg/アトルバスタチン5mg)、2番(アムロジピン2.5mg/アトルバスタチン10mg)、3番(アムロジピン5mg/アトルバスタチン5mg)投与による、投与8週時におけるベースラインからのLDLコレステロールの変化率(%)と収縮期血圧の変化量(mmHg)[最小二乗平均(両側95%信頼区間)]を示す(主要評価項目)。
カデュエット配合錠1番:LDLコレステロール変化率;-37.2(-40.2, -34.3)、収縮期血圧変化量;-16.6(-19.8, -13.3)(n=43)
カデュエット配合錠2番:LDLコレステロール変化率;-42.5(-45.5, -39.5) 、収縮期血圧変化量;-15.9(-19.3, -12.6)(n=41)
カデュエット配合錠3番:LDLコレステロール変化率;-34.3(-37.3, -31.3) 、収縮期血圧変化量;-21.8(-25.1, -18.4)(n=41)
足達 寿ほか:新薬と臨牀 58(9):1496, 2009より作図(著者の一部はヴィアトリス社の製造販売承認承継元であるファイザー社に所属)
目的
カデュエット配合錠を投与した場合の投与8週時のベースライン時からの収縮期血圧の変化量およびLDLコレステロールの変化率を検討する。
対象
20歳以上80歳未満の高コレステロール血症と高血圧症を合併している外来患者165例。
方法
多施設共同無作為化非盲検並行群間比較試験。患者をカデュエット配合錠1番(アムロジピン2.5mg/アトルバスタチン5mg)群(43例)、2番(アムロジピン2.5mg/アトルバスタチン10mg)群(41例)、3番(アムロジピン5mg/アトルバスタチン5mg)群(41例)、4番(アムロジピン5mg/アトルバスタチン10mg)群(40例)に割り付け8週間投与し、ベースラインからの収縮期血圧の変化量およびLDLコレステロールの変化率を評価した。
評価項目
主要評価項目:
投与8週時のベースラインからの収縮期血圧の変化量およびLDLコレステロールの変化率。
副次評価項目:
投与8週時を除く各評価時点での収縮期血圧、拡張期血圧、LDLコレステロール/HDLコレステロール比など。
解析計画
主要評価項目はベースライン値を共変量、カデュエットの用量ならびにその交互作用を要因とする共分散分析モデルを用いて解析し、投与群別に最小二乗平均値ならびにその両側95%信頼区間を算出した。
安全性
有害事象はカデュエット配合錠1番群で43例中18例(41.9%)に26件、カデュエット配合錠2番群で41例中16例(39.0%)に30件、カデュエット配合錠3番群で41例中17例(41.5%)に24件、カデュエット配合錠4番群で40例中16例(40.0%)に19件認められた。最も高頻度に認められた因果関係を問わない有害事象は鼻咽頭炎で、全体では21例(12.7%)、投与群別では3~7例(7.3~17.5%)に認められた(内訳について論文に記載なし)。
また、因果関係を否定できない有害事象は、カデュエット配合錠1番群で43例中6例(14.0%)に8件、カデュエット配合錠2番群で41例中6例(14.6%)に10件、カデュエット配合錠3番群で41例中5例(12.2%)に6件、カデュエット配合錠4番群で40例中5例(12.5%)に6件認められた。因果関係を否定できない主な有害事象は動悸、肝機能異常、浮動性めまいおよび頭痛で、全体で2例(1.2%)ずつ認められた。投与群別では各群1例ずつの報告であった(内訳について論文に記載なし)。
重度の有害事象はカデュエット配合錠2番群の1例に2件(悪心および頭痛)認められ、いずれも治験薬との因果関係は否定できないと判断された。
有害事象による投与中止は全体で5例[腹部膨満/悪心、血圧上昇および頭痛/片頭痛/浮動性めまい/不眠症(内訳について論文に記載なし)]、カデュエット配合錠1番群で1例、カデュエット配合錠2番群で2例、カデュエット配合錠3番群で1例、カデュエット配合錠4番群で1例認められ、いずれも治験薬との因果関係は否定できないと判断され、いずれも投与中止後に消失が確認された。
死亡例はなかった。
アムロジピン服用中スタチン未服用の患者に対する、アムロジピン単剤投与からカデュエット配合錠への切り替えによる脂質・血圧コントロール
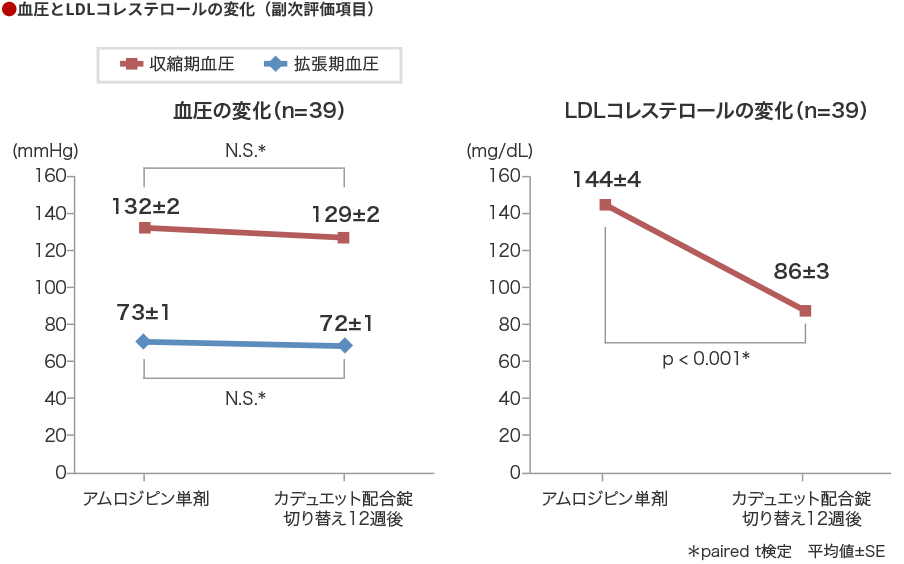
アムロジピンを少なくとも4週間以上服用し、血清LDLコレステロール値が100mg/dLを超えるスタチン未服用の安定冠動脈疾患を有する高コレステロール血症・高血圧症患者さんに対して、アムロジピン5mg単剤内服をカデュエット配合錠4番または3番に変更し、1日1回、12週間投与した結果、血圧の管理は維持され、LDLコレステロールは有意に低下しました。
● 冠動脈疾患の再発リスクスコアであるFraminghamリスクスコア(2年リスク)とJ-LITチャート2(6年リスク)のカデュエット配合錠切り替え前後の変化(主要評価項目)
Framinghamリスクスコアによる2年間の冠動脈疾患の再発リスクは変更前9.2±0.8%から変更後7.5±0.7%と18.5%の有意な低下(p<0.001、paired t検定)を認めた。また、J-LITチャート2によるリスク解析の結果、6年間の冠動脈疾患の再発リスクは変更前13.2±1.3%から変更後10.8±1.0%と18.2%の有意な低下(p<0.001、paired t検定)を認めた。
小住清志、太﨑博美ほか: Therapeutic Research 33(6): 905, 2012より作図
目的
高血圧を有し、LDLコレステロール管理目標未達の安定冠動脈疾患患者に対して、カデュエット配合錠使用によりどのような血圧脂質改善作用が得られ、その結果心血管疾患再発リスクの確実な軽減が得られるかについて検討する。
対象
安定冠動脈疾患を有する高コレステロール血症・高血圧症患者のうち、少なくとも4週間以上Ca拮抗薬(アムロジピン)を服用し、血清LDLコレステロール値が100mg/dLを超えるスタチン未服用の患者39例。
方法
アムロジピン5mg単独内服をカデュエット配合錠4番(アムロジピン5mg/アトルバスタチン10mg)、またはカデュエット配合錠3番(アムロジピン5mg/アトルバスタチン5mg)に変更し、1日1回、12週間投与した。カデュエット配合錠切り替え12週後の血圧およびLDL-Cなどを評価した(前向き試験)。
評価項目
主要評価項目:
FraminghamリスクスコアおよびJ-LITチャート2によるリスク評価。
副次評価項目:
BMI、外来時血圧、脈拍、総コレステロール、LDLコレステロール、HDLコレステロール、LDLコレステロール/HDLコレステロールなど。
解析計画
Stat View software(ver.5.01)を用い、有意差判定はpaired t検定を用いた。数値は平均値±標準誤差で表し、有意水準は5%未満とした。
安全性
論文中に記載なし。
