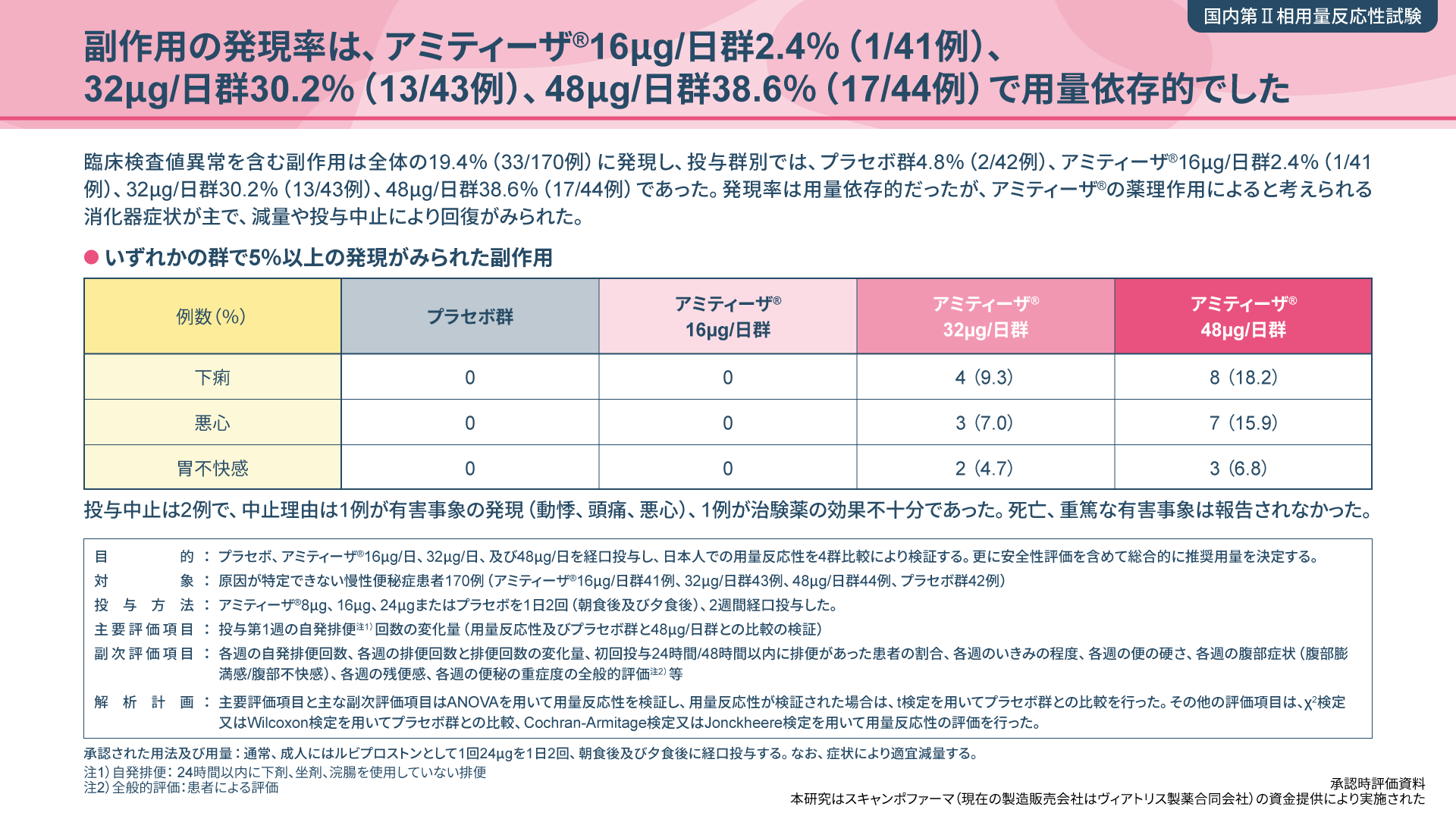
第1回:トレーシングレポートの基礎









薬剤師は日常業務の中で、患者さんの服薬状況や副作用など、さまざまな情報を得る機会があります。
こうした情報を適切に医師に共有することで、
より患者さんに適した治療選択につながると考えられます。
そのための情報共有の手段のひとつがトレーシングレポートです。
本シリーズでは2回にわたって、トレーシングレポートに記載する内容から
具体的な作成のポイントまで詳しくご紹介します。
今回は、トレーシングレポートの基本情報や記載のコツをご紹介します。
トレーシングレポートとは?
トレーシングレポートは、薬剤師が得た患者さんの情報を処方医に共有するための文書です。その目的は、薬剤師が「緊急性は低いが医師に伝えるべき」と判断した情報を医師に共有することで、より適切で安全な治療選択を支援することだと考えます。
また、トレーシングレポートを通じて医師に情報を共有することは、患者さんにとってより良い治療につながるだけでなく、薬剤師と医師の信頼関係の構築にも寄与します。
たとえば、定期的にトレーシングレポートを送付することで、医師の中で「この薬局はしっかり情報を共有してくれる」「患者さんの状況を丁寧に把握している」と認識されるようになり、薬局や薬剤師の印象が残りやすくなります。その結果、疑義照会や勉強会の場面で会話のきっかけになることもあります。
さらに、トレーシングレポートを提供することで、服薬情報等提供料として以下を算定することができます1)。
- 1) 診療報酬の算定方法の一部を改正する告示. 令和6年厚生労働省告示第57号. 別表第三(調剤点数表)

-
保険医療機関からの
求めに応じて
情報提供を行った場合 30点(月1回)

-
薬剤師が必要と認め、
医療機関等へ
情報提供を行った場合 20点(月1回) (保険医療機関、リフィル処方箋調剤後の
処方医、介護支援専門員)

-
入院前の患者について、
保険医療機関からの求めに応じて
情報提供を行った場合 50点(3ヵ月に1回)
- ※いずれも、患者さんの同意と文書による情報提供が必要
トレーシングレポート記載・送付のポイント
それでは、トレーシングレポートに記載すべき内容と記載のコツ、
そして初めての医療機関に送付する際のポイントをご紹介します。
トレーシングレポートの内容
トレーシングレポートに記載する内容は、患者さんから得た情報の中で、薬剤師が「緊急性は低いが医師に伝えるべき」と判断した情報です。では、この「緊急性は低いが医師に伝えるべき」情報にはどのようなものがあるのでしょうか?
記載する内容としては、患者さんの情報を報告する報告・情報共有型と、処方提案を行う提案型の2種類あります。


報告・情報共有型
- 患者さんの訴え(効果、副作用の状況など)に関する情報の報告
- 併用薬など(他院処方薬、OTC医薬品、サプリメントなど)の服薬状況の報告
- 服薬アドヒアランスの報告

提案型
- 処方変更提案
- 服薬アドヒアランス向上のための提案
ところで、どのような情報がより良いトレーシングレポートにつながるのでしょうか?
トレーシングレポートでは、医師が診察時に把握することが難しい患者さんの情報を補完することで、より有用なレポートになります。
たとえば、日常診療でよくみられる便秘症状においては、OTC医薬品で対処している患者さんや、そもそも便秘症を病気と認識していない患者さんもおり、便秘症状に悩んでいても医師に相談していないケースがあります。そのような患者さんの情報を把握し、医師に共有することで、適切な治療選択につながります。
また、便秘症の原因となりうる薬剤の服薬状況の共有や、便秘症治療薬の効果が出すぎていると思われる場合の減量の提案なども、医師が診察時に把握・検討しづらい情報のひとつと考えられます。こうした患者さんごとの背景や治療反応なども共有することで、より個々に適した治療選択や用量調整につながります。
記載のコツ
情報を伝える際は、内容だけでなく伝え方も重要です。
そのため、医師にとってよりわかりやすい表現や形式を用いることで情報が正確に伝わり、より適切な治療選択につながると考えます。また、丁寧で配慮のある表現を心がけることで、医師に受け入れてもらいやすくなり、円滑なコミュニケーションにつながります。
以下に書き方のコツをまとめたのでみてみましょう。


提案の伝え方を工夫する
- 一方的な表現にならないよう、対話する姿勢で伝える
例:「処方を変更してください」ではなく、「処方の際に検討をお願いします」とする - 医師が忙しい合間にも素早く要点を把握できるよう、提案を先に記載する
例:「○○のご提案をさせていただきます」と結論を記載した後、患者さんの状態を記載する

患者さん中心の視点で記載する
- 薬剤師の意見ではなく、患者さんの状況を主体にする
「私はこう思います」といった薬剤師の主観的な意見だけではなく、患者さんの状態を客観的に伝えながら提案することで、医師に受け入れてもらいやすくなる
例:「患者さんがアミティーザ®を服用しており、悪心を訴えているため、□□の提案をさせていただきます」

根拠を明確にする
- 添付文書やインタビューフォーム、ガイドライン、論文などのエビデンスを示す
例:「〇〇のガイドラインにおいても△△が推奨されており…」
また、以下のような基本的なポイントも、あらためて意識することでより伝わりやすい内容になります。

形式面に注意する
- 手書きではなく、
パソコンで作成する - 誤字脱字に注意する
- 簡潔に箇条書きで記載する
初めての医療機関に
トレーシングレポートを
送付する場合
トレーシングレポートの送付先には、今までに送付したことのある医療機関もあれば、初めて送付する医療機関もあると思います。医療機関によっては、トレーシングレポートの受け取りに慣れていない場合もあるため、初回送付時のポイントをご紹介します。
大規模な病院では、トレーシングレポートの送付に関するプロトコルやフォーマットが決まっている場合があるため、事前に病院のホームページを確認すると良いでしょう。
小規模なクリニックでは、送付する前にあいさつも兼ねて電話をすることで、やり取りがスムーズになり、送付先でのトレーシングレポートの受け取りや確認がしやすくなります。
さらに、トレーシングレポートは情報提供だけでなく、医師とのコミュニケーションのきっかけとしても活用できます。たとえば、トレーシングレポートを持参し、直接医師に説明することで、医師やクリニックとのつながりが生まれ、関係を深める機会にもなります。

トレーシングレポートを活用し、
医師に患者さんの情報を共有することは、
患者さんのためになるだけでなく、
医師との信頼関係の構築にもつながります。
次回はトレーシングレポートの実践として、
アミティーザ®を使用している
慢性便秘症患者さんを例に、
実際の記載のポイントをご紹介します。
伝わる工夫と実践ポイント
第2回:トレーシングレポート
の実践はこちら