第2回:トレーシングレポートの実践









トレーシングレポートは、薬剤師が得た患者さんの情報を処方医に共有するための文書です。
本シリーズでは2回にわたって、トレーシングレポートに記載する内容から
具体的な作成のポイントまで詳しくご紹介します。
前回はトレーシングレポートの基本情報や記載のコツをご紹介しました。
今回は、トレーシングレポートの実践として、
慢性便秘症※治療薬アミティーザ®を使用している患者さんを例に、
実際の記載のポイントを紹介します。
※慢性便秘症(器質的疾患による便秘を除く)
トレーシングレポート記載の
ポイント
まずは前回ご紹介した、トレーシングレポートを書くコツを確認しましょう。


提案の伝え方を工夫する
- 一方的な表現にならないよう、対話する姿勢で伝える
例:「処方を変更してください」ではなく、「処方の際に検討をお願いします」とする - 医師が忙しい合間にも素早く要点を把握できるよう、提案を先に記載する
例:「○○のご提案をさせていただきます」と結論を記載した後、患者さんの状態を記載する

患者さん中心の視点で記載する
- 薬剤師の意見ではなく、患者さんの状況を主体にする
「私はこう思います」といった薬剤師の主観的な意見だけではなく、患者さんの状態を客観的に伝えながら提案することで、医師に受け入れてもらいやすくなる
例:「患者さんが〇〇を服用しており、△△の変化を感じているため、□□の提案をさせていただきます」

根拠を明確にする
- 添付文書やインタビューフォーム、ガイドライン、論文などのエビデンスを示す
例:「〇〇のガイドラインにおいても△△が推奨されており…」

形式面
- 手書きではなく、
パソコンで作成する - 誤字脱字に注意する
- 簡潔に箇条書きで記載する
また、より正確に情報を伝えるためには、一度書いたトレーシングレポートを読み返すこともポイントのひとつです。さらに、自分で読み返すだけでなく、第三者に確認してもらうことで、誤解を招く表現や記載ミスがないかを客観的に見直すことができます。
トレーシングレポートの
記載例

CASE
- 年齢・性別
- 60歳 女性(パート勤務)
- 処方内容
- アミティーザ®カプセル24µg 2回/日
- 合併症
- 骨粗鬆症、高血圧症
- 併用薬
- 降圧剤(降圧剤以外の薬剤なし)
- 経過
- 慢性便秘症の治療のため、アミティーザ®カプセル24µg 2回/日で服用中
薬剤師が便の様子をヒアリングすると、まれに下痢がみられる日があり、特に勤務時に不便を感じていることがわかった
現状、日常生活に大きな支障はなく、患者さんは本日時点での緊急的な減量は希望していない
ただし、今後、下痢による不便さが増す場合は、減量を希望する意向とのことだった
また、上記の情報について、患者さんは本日の診察で医師には話していなかった
アクション
患者さんが診察時に伝えていなかった情報を医師に共有し、次回以降の診察時に、必要に応じてアミティーザ®カプセル24µg 1回/日またはアミティーザ®カプセル12µg 2回/日への減量を検討してもらえるよう、トレーシングレポートを作成する。
処方提案の場合の記載例
お世話になっております。
【患者情報】
- ・年齢・性別:60歳 女性(パート勤務)
- ・処方内容:アミティーザ®カプセル24μg 2回/日
- ・合併症:骨粗鬆症、高血圧症
- ・併用薬:降圧剤(降圧剤以外の薬剤なし)
【取得情報】
患者様より、以下の申し出がありました。
- ・週にx回、下痢がみられる日があり、特に勤務時に不便を感じることがある
(勤務中に急な便意があり、トイレのタイミングを気にすることが増えた など) - ・現状、日常生活に大きな支障はなく、本日時点での減量は希望しない
- ・今後、下痢による不便さが増す場合は、減量を希望する意向である
- ・診察時には、この内容を伝えていなかったため、情報共有のため申し送りを希望している
わかりやすいよう
箇条書きに!
患者さんは不便さを
感じていたのか・・・
日常生活、体調:変化なし
併用薬:降圧剤のみ
服薬状況:アドヒアランス良好(残薬なし)
排便頻度:XX回/週
便形状:ブリストルスケールXX x回/週、YY y回/週
【提案・対応】
- ・現状、生活に大きな支障はなく、継続希望とのことだったため、今回は処方どおりに服用するよう説明しました
- ・今後、下痢による不便さが増すようであれば、アミティーザ®カプセル24μg 1回/日への減量についてご検討いただけますと幸いです
- ・また、将来的により細かい用量調整が必要になる可能性を考慮し、アミティーザ®カプセル12μg 2回/日への減量も選択肢のひとつかと存じます
減量の際の選択肢も
整理されていて、
参考になるね
次回以降の診察時に、ご検討いただけますでしょうか。
提案の根拠を添付!
アミティーザ®(24μgカプセル・12μgカプセル)のインタビューフォームを添付いたします。
減量をご検討いただく際の参考としていただけますと幸いです。
ご検討の程よろしくお願いいたします。
最後に
今回の事例のように、薬剤師が患者さんとの会話で得た情報は、
必ずしも患者さん自身が医師に伝えているわけではありません。
医師にとって重要な情報をトレーシングレポートで共有することで、
患者さんのより良い治療につながり、
また、患者さんや医師からの信頼を得ることができると考えています。
今回ご紹介した記載のポイントをもとに、
まずは1枚、トレーシングレポートを書いてみてはいかがでしょうか。
伝わる工夫と実践ポイント
第1回:トレーシングレポート
の基礎はこちら





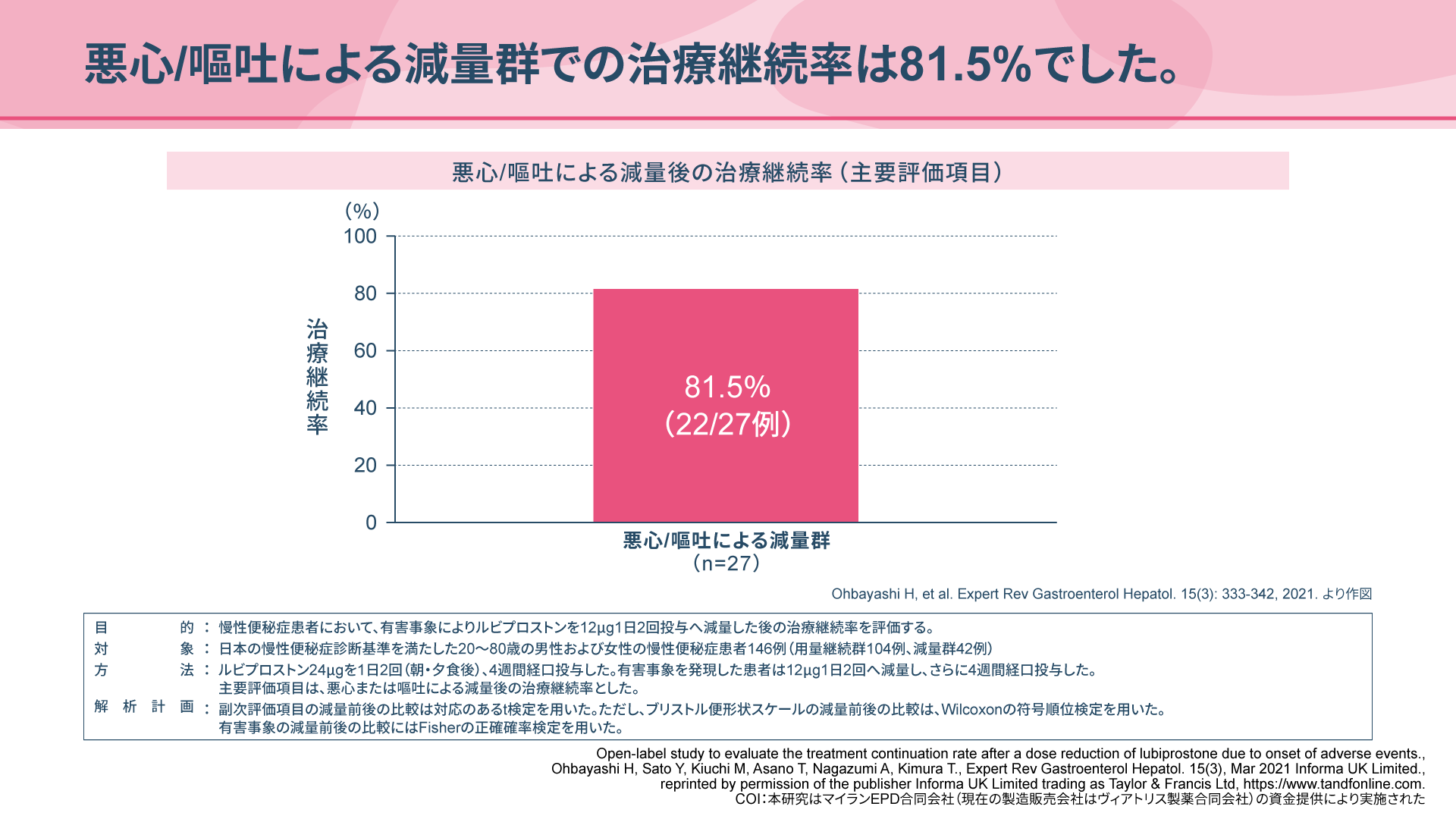
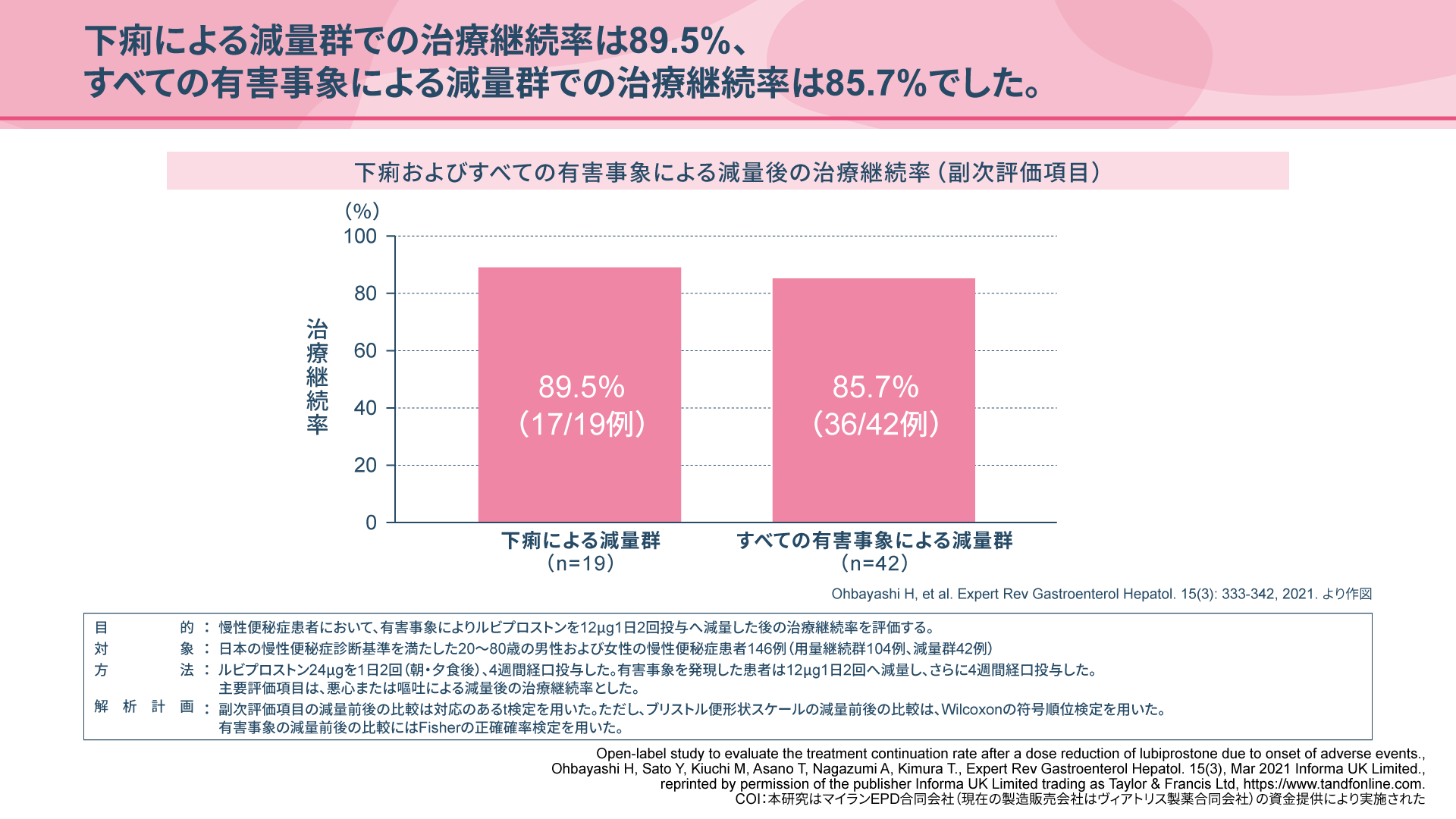
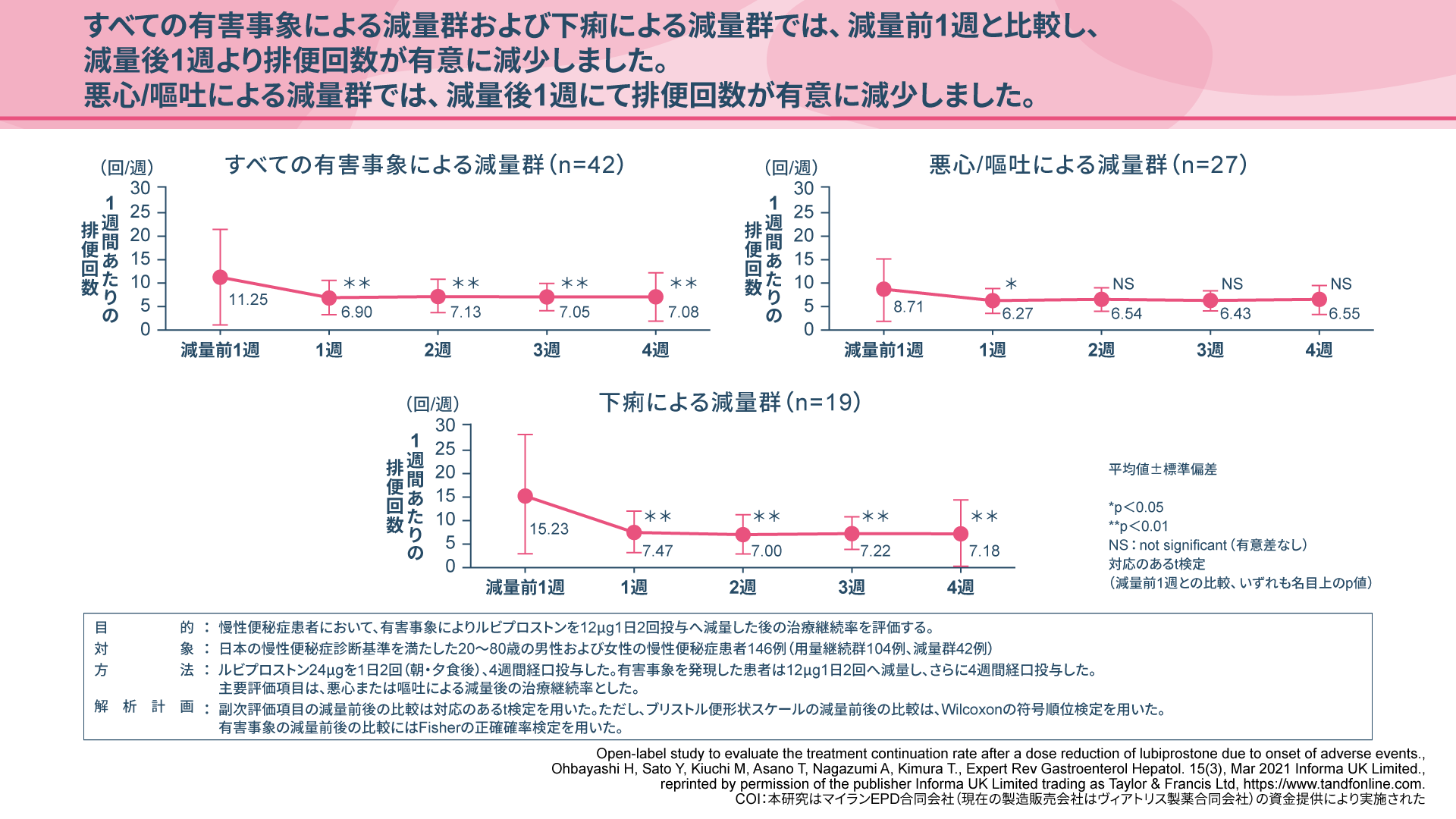

慢性便秘症患者様におけるアミティーザ®の減量について(ご検討のお願い)
結論を先に記載!