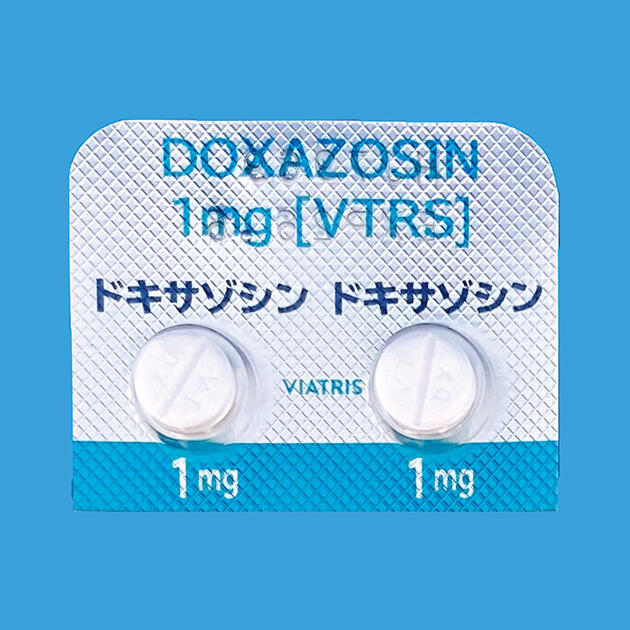
ドキサゾシン1mg
ドキサゾシン錠1mg「VTRS」
-
更新情報 2024年11月
| ドキサゾシン錠1mg「VTRS」 | 先発・準先発製品 | |
|---|---|---|
| 製品名 | ドキサゾシン錠1mg「VTRS」 | カルデナリン錠1mg |
| 製造販売及び 取扱い会社名 |
製造販売元:ヴィアトリス・ヘルスケア合同会社
販売元:ヴィアトリス製薬合同会社
|
製造販売元:ヴィアトリス製薬合同会社
|
| ドキサゾシン錠1mg「VTRS」 | |||||
|---|---|---|---|---|---|
| 成分・含量 | ドキサゾシン1mg | 薬効分類名 | 血圧降下剤 | ||
| 診療報酬上の 取扱い |
後発品 | 効能効果一致 /不一致 |
同 | ||
| 規制区分 | 処方箋医薬品 | 性状 | 白色の素錠(割線入り) | ||
| 錠剤サイズ | 直径6.8mm、厚さ2.8mm | 貯法 | 室温保存 | ||
| 包装単位 | 調剤包装単位サイズ (mm) |
販売包装単位サイズ (mm) |
GS1: 調剤包装単位 |
GS1: 販売包装単位 |
|
|---|---|---|---|---|---|
| 包装 ・ GS1コード |
100錠(PTP) (10錠シート) |
縦101.0×横35.0 | 縦50×横35×奥行125 |

|

|
| 製剤工夫 |
|---|
|
|
Adobe PDF形式形式のデータをご覧いただくには、アドビシステムズ社のAdobe Readerが必要になります。
最新のAdobe
ReaderはAdobe社のWebサイトより無料でダウンロードすることができます。
2024/11/01
2024年11月1日時点の電子添文等に基づいています。